
العوامل المؤثرة على حالة الاتزان
1- تركيز المواد .
2- الضغط .
3- درجة الحرارة .
مبدأ لوشاتلييه
إذا أثر مؤثر ما ( مثل التركيز أو الضغط أو درجة الحرارة ) على تفاعل في حالة الاتزان فإن التفاعل يسير في الاتجاه الذي يقلل فيه من فعل هذا المؤثر .
When a stress is applied to a system at equilibrium the system will adjust to relieve the stress
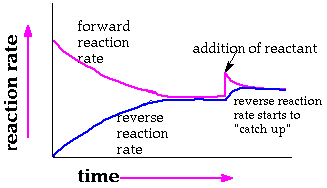
أولاً : أثر التركيز على حالة الاتزان
وجد عملياً أنه بزيادة تركيز إحدى المواد المتفاعلة فإن التفاعل سيسير في الاتجاه الأصلي نحو تكون المزيد من المواد الناتجة .
وعند زيادة تركيز إحدى المواد الناتجة فإن التفاعل يسير في الاتجاه العكسي نحو تكون المزيد من المواد المتفاعلة ، والعكس بالعكس .
وفي كل الحالات تبقى قيمة ثابت الاتزان K ثابتة لا تتغير فتغير التركيز لا يؤثر على قيمة ثابت الاتزان .
ويمكن تفسير هذا الأثر وفق مبدأ لوشاتلييه على اعتبار أن زيادة تركيز احدى المواد المتفاعلة ( مثلاً ) يؤدي إلى اختلال الاتزان فيكون هذا هو المؤثر ولكي يحافظ التفاعل على حالة الاتزان فإنه سيعتريه تغير في الاتجاه الذي يقلل من فعل هذا المؤثر وهو هنا بسير التفاعل في الاتجاه الاصلي . فالكمية المضافة من المادة المتفاعلة ستتوزع في طرفي المعادلة ( جزء يبقى متفاعلات وجزء يتحول لنواتج ) ليصل التفاعل إلى حالة اتزان جديدة تبقى فيها قيمة ثابت الاتزان للتفاعل ثابتة لا تتغير .
ثانياً : أثر الضغط على حالة الاتزان
يقتصر أثر الضغط في التفاعلات المتزنة على التفاعلات الغازية فقط ووجد عملياً أن أثرالضغط على حالة الاتزان يتوقف على نوع التفاعل من حيث تساوي عدد مولات المواد في طرفي المعادلة أو عدم تساويها ، ففي التفاعلات التي يكون فيها عدد مولات المواد المتفاعلة يساوي عدد مولات المواد الناتجة وجد أن تغير الضغط لا يؤثر على حالة الاتزان ولا على قيمة ثابت الاتزان K بالطبع .
أما بالنسبة للتفاعلات التي تختلف فيها عدد مولات المواد في طرفي المعادلة فوجد أنه بزيادة الضغط ( زيادة الضغط على النظام بالكامل ) فإن التفاعل يتجه نحو الطرف الذي يكون فيه عدد مولات المواد أقل ، وبنقص الضغط يتجه التفاعل نحو عدد المولات الأكثر ولا تتأثر هنا قيمة ثابت الاتزان K أيضاً .
ويمكن تفسير هذا الأثر من خلال مبدأ لوشاتلييه على أساس أنه عند زيادة الضغط ( على التفاعل بالكامل ) فإن الضغط الناشيء عن المواد ( المتفاعلة أو الناتجه ) ذات عدد المولات الأكثر سيكون أكبر ( تذكر أن الضغط الجزئي للغازات يعتمد على عدد الجسيمات وليس نوعها ) فيكون هذا المؤثر ومن ثم فإن رد الفعل للتقليل من هذا المؤثر فإن التفاعل سيتجه نحو الطرف الذي تكون فيه عدد المولات أقل ليصل التفاعل إلى حالة اتزان جديدة تكون عندها قيمة ثابت الاتزان K مساوية لقيمة ثابت الاتزان قبل زيادة الضغط أي أن قيمة ثابت الاتزان لا تتغير بتغير الضغط .
ثالثاً : أثر درجة الحرارة على حالة الاتزان
يتوقف أثر درجة الحرارة في التفاعلات المتزنة على نوع التفاعل من حيث المحتوى الحراري ففي التفاعلات الماصة للحرارة وجد عملياً أن ارتفاع درجة الحرارة في التفاعل المتزن تجعل التفاعل يسير في الاتجاه الأصلي نحو تكوين المزيد من المواد الناتجة ( على حساب المواد المتفاعلة ) بمعنى أنه في هذه الحالة سيزداد تركيز المواد الناتجة ( الموجودة في بسط قانون الاتزان ) ويقل تركيز المواد المتفاعلة ( الموجودة في المقام ) لذلك نجد أن قيمة ثابت الاتزان تزداد بارتفاع درجة الحرارة في التفاعلات الماصة للحرارة ، والعكس صحيح بخفض درجة الحرارة .
وفي التفاعلات الطاردة للحرارة وجد عملياً أن ارتفاع درجة الحرارة في التفاعل المتزن تجعل التفاعل يسير في الاتجاه العكسي نحو تكون المزيد من المواد المتفاعلة ( على حساب المواد الناتجة ) بمعنى أنه في هذه الحالة سيزداد تركيز المواد المتفاعلة ( الموجودة في مقام قانون الاتزان ) ويقل تركيز المواد الناتجة ( الموجودة في البسط ) لذلك نجد أن قيمة ثابت الاتزان تقل بارتفاع درجة الحرارة في التفاعلات الطاردة للحرارة ، والعكس صحيح بخفض درجة الحرارة .
ويمكن تفسير أثر الحرارة على حالة الاتزان وفق مبدأ لوشاتلليه على افتراض أننا يمكن اعتبار الحرارة في التفاعلات الماصة للحرارة وكأنها مادة متفاعلة فعندما نرفع درجة الحرارة نكون كأننا أضفنا كمية من المادة المتفاعلة للتفاعل فيكون رد فعل التفاعل للتقليل من هذا المؤثر هو اتجاه التفاعل في الاتجاه الأصلي . والشيء نفسه يحدث في التفاعلات الطارة للحرارة فيمكن اعتبار الحرارة هنا وكأنها مادة ناتجة .
المواد الحافزة وجد عملياً بأنها لاتؤثر على حالة الاتزان اطلاقاً ويتوقف أثرها على زيادة سرعة الوصول إلى حالة الاتزان عن طريق زيادة سرعة التفاعليين العكسيين .
ومن ثم فإنها لاتؤثر على قيمة ثابت الاتزان K أيضاً .وكذلك السموم فليس لها تأثير لا على حالة الاتزان ولا قيمة ثابت الاتزان
وهنا فلاش توضيحي لاثر التركيز والضغط والحرارة
7
7
7
http://www.mhhe.com/physsci/chemistr...sh/lechv17.swf
الموضوع مجمع لحفظ الحقوق
أبوعبد الرحمن
مشرف تربوي/ كيمياء
{ رَبّ إِنِّي لِمَا أَنْزَلْت إِلَيَّ مِنْ خَيْر فَقِير }
شـــجاني حبها حتى بكيـــــت وفي قلبي لها شوقا"بنيت
فقالت:هل سعيت لكي تراني؟ فقلت: أنا لغيرك ماسعيتلأنـك ياجنة الفـردوس عنــدي أغــلى وأسمــى ماتمنيت
جميل ما كتبت
أخي أبا عبدالرحمن
وتصدق عندما قرأت الموضوع
كأني في فصلي ثالث ثانوي
لك كل الشكر

كل الشكر والتقدير اخي رياض على مرورك ودعمك المعنوي0
وأسال الله لك ولجميع الأخوة الأعضاء التوفيق والسداد وان يبارك في جهود الجميع0 وأن يكون لنا الشرف في المساهمة مع الكوكبة من نجوم سماء هذا الصرح الشامخ ورواد المعرفة والتربية 0
أبوعبد الرحمن
مشرف تربوي/ كيمياء
{ رَبّ إِنِّي لِمَا أَنْزَلْت إِلَيَّ مِنْ خَيْر فَقِير }
شـــجاني حبها حتى بكيـــــت وفي قلبي لها شوقا"بنيت
فقالت:هل سعيت لكي تراني؟ فقلت: أنا لغيرك ماسعيتلأنـك ياجنة الفـردوس عنــدي أغــلى وأسمــى ماتمنيت
طرح وأسلوب سهل وبسيط
لك الشكر على ما قدمت
مشرف تربوي / كيمياءمدرب على إستراتيجيات التدريسمدرب على مشروع تطوير العلوم

السلام عليكم
أخي العزيز الموضوع ليس مجمّعاً! بل هو من موضوعاتي القديمة التي نشرتها في بيوتات الكيمياء قبل أكثر من سبع سنوات.
وهذا التنويه ليس لحفظ الحقوق، فما أنشره على الشبكة مشاع للجميع، بل لعجبي من سياسة المنتدى فيما يتعلّق بالحذف والإبقاء!!!
شكراً لك.



رائع أستاذي الفاضل/أبو عبدالرحمن

كل الشكر والتقدير للاخوة علي -عمر دمعة على المرور0
أخي عمر مغربي انا لم انسب الموضوع لي بل انا اهتم بحقوق الناس في النشر والنقل 0 لي موضوع في هذا المنتدي عن حفظ حقوق الاخرين تحت موضوع (والله من وراء القصد )0
وما قصدته بعملية مجمع هو الدرس والفلاش المضمن للعضو ultravoilt والاهم من ذلك ان يستفيد الجميع ولكم الاجر والثواب0
وننتظر ابداعك ومشاركاتك لتثري بها المنتدي0
لك كل التحية والتقدير0
أبوعبد الرحمن
مشرف تربوي/ كيمياء
{ رَبّ إِنِّي لِمَا أَنْزَلْت إِلَيَّ مِنْ خَيْر فَقِير }
شـــجاني حبها حتى بكيـــــت وفي قلبي لها شوقا"بنيت
فقالت:هل سعيت لكي تراني؟ فقلت: أنا لغيرك ماسعيتلأنـك ياجنة الفـردوس عنــدي أغــلى وأسمــى ماتمنيت
المفضلات